论 《黄帝内经》 和易经揭“没有灵魂”的生物DNA/RNA基因Watson表的内秘

作者:金日光
国际上第四统计力学创始人
中医药国际联盟中国区主席
世界华人报网总编
一、沃森表(Watson’s Table)的由来与现状
引言
“DNA之父”沃森(Watson)排斥女性科学家罗莎琳德·富兰克林对DNA双螺旋结构的贡献,他同克里克(Crick)共同获得了诺贝尔奖,世人在背后替罗莎琳德骂他们,也许是这个原因,克里克就先走西天了,并以227万美元价拍卖了诺贝尔奖章;今年沃森又拍卖获得480万美元。据说前一个由一位中国富者拍得,后一个由俄罗斯的富翁拍得,以支持沃森的科研工作。总之这种诺贝尔奖无法得到人们的赞赏。今天我们再来看沃森借许多人的研究成果而归纳的一张有关DNA中四种碱基和二十种氨基酸之间匹配的关系表,有人把这张表称之为“沃森表”( Watson's Table,见表1)。
表1 DNA四种碱基与二十种氨基酸之间关系的实验总结表
|
第一位(5′端) 核苷酸 |
第二位(中间)核苷酸 |
第三位(3′端) 核苷酸 |
|||
|
U |
C |
A |
G |
||
|
U |
苯丙氨酸(Phe,F) |
丝氨酸 (Ser,S) |
酪氨酸 (Tyr,Y) |
半胱氨酸(Cys,C) |
U |
|
苯丙氨酸(Phe,F) |
丝氨酸 (Ser,S) |
酪氨酸 (Tyr,Y) |
半胱氨酸(Cys,C) |
C |
|
|
亮氨酸 (Leu,L) |
丝氨酸 (Ser,S) |
终止 (Stop) |
终止 (Stop) |
A |
|
|
亮氨酸 (Leu,L) |
丝氨酸 (Ser,S) |
终止 (Stop) |
色氨酸 (Trp,W) |
G |
|
|
C |
亮氨酸 (Leu,L) |
脯氨酸 (Pro,P) |
组氨酸 (His,H) |
精氨酸 (Arg,R) |
U |
|
亮氨酸 (Leu,L) |
脯氨酸 (Pro,P) |
组氨酸 (His,H) |
精氨酸 (Arg,R) |
C |
|
|
亮氨酸 (Leu,L) |
脯氨酸 (Pro,P) |
谷氨酰胺 (Gln,Q) |
精氨酸 (Arg,R) |
A |
|
|
亮氨酸 (Leu,L) |
脯氨酸 (Pro,P) |
谷氨酰胺 (Gln,Q) |
精氨酸 (Arg,R) |
G |
|
|
A |
异亮氨酸(Ile,I) |
苏氨酸 (Thr,T) |
天冬酰胺(Asn,N) |
丝氨酸 (Ser,S) |
U |
|
异亮氨酸(Ile,I) |
苏氨酸 (Thr,T) |
天冬酰胺(Asn,N) |
丝氨酸 (Ser,S) |
C |
|
|
异亮氨酸(Ile,I) |
苏氨酸 (Thr,T) |
赖氨酸 (Lys,K) |
精氨酸 (Arg,R) |
A |
|
|
甲硫氨酸(Met,M) |
苏氨酸 (Thr,T) |
赖氨酸 (Lys,K) |
精氨酸 (Arg,R) |
G |
|
|
G |
缬氨酸 (Val,V) |
丙氨酸 (Ala,A) |
天冬氨酸 (Asp,D) |
甘氨酸 (Gly,G) |
U |
|
缬氨酸 (Val,V) |
丙氨酸 (Ala,A) |
天冬氨酸 (Asp,D) |
甘氨酸 (Gly,G) |
C |
|
|
缬氨酸 (Val,V) |
丙氨酸 (Ala,A) |
谷氨酸 (Glu,E) |
甘氨酸 (Gly,G) |
A |
|
|
缬氨酸 (Val,V) |
丙氨酸 (Ala,A) |
谷氨酸 (Glu,E) |
甘氨酸 (Gly,G) |
G |
|
从上述表中可以看出,一群氨基酸与三联体密码子中的中心碱基结构有密切的关系。有人把这张表说成可与门捷列夫元素周期表的发现相媲美[1]。但是许多人也在讽刺说这是“没有灵魂”的一张表。因为Watson只是善于利用他人的成果,而根本没有提出为什么一切生物体的DNA最多有64个密码子,又为什么二十种氨基酸正好分别匹配于DNA中的四种碱基(A、G、C、T)的根本原因。在这种情况下,许多人都尝试从理论上来诠释上述匹配的规律[2-4]。然而几十年过去了,遗憾的是一直都未能取得突破性的进展。在人类进入21世纪之际,Watson提出的匹配表格仍然是尚未得到诠释的生命科学的重大谜团之一。现在中国人尽管没有得到到诺贝尔奖,但可用中国远古《黄帝内经》阴阳学说和易经(太极八卦及六十四卦)的当代科学内涵的理论,使这个谜团得以最终的揭明!
二、从《黄帝内经》阴阳学说看DNA四种碱基的阴阳性,
《黄帝内经》阴阳学说告诉我们一切自然界的阴阳有大的四种:
阳中之阳(++)
阳中之阴(+-)
阴中之阴(--)
阴中之阳(-+)
在具体分布里有“中中之中”的第五种,故称之为五行学说。
一切生命体的基因由四种碱基串联成DNA,RNA。
我们从四种碱基结构的电荷分布很容易发现下列事实:
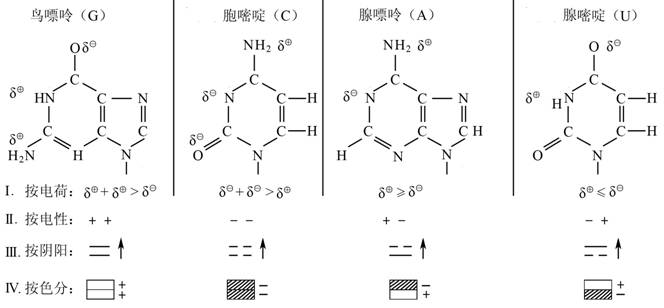
这些四种碱基进一步同磷酸苷作用,形成磷酸核苷。但是西方科学界忽视这些分子的形成以及进一步变为长长链的DNA,RNA时,所存在的一切生命体演变化过程中的生命动力源的阴精和阳精的催化作用。
当代分子生物学及量子生物学都指出:在远古生命的原始“化学汤”里,在开始先有过各种核苷酸和氨基酸通过三聚磷酸互相连接的复合型二元单体分子,经双向聚合反应,生成RNA及相应的蛋白体,后由RNA转化为更加稳定、更长链的DNA,从此生物蛋白质的合成的途径变成为先由DNA,复制出t-RNA,用来运输各种氨基酸;又从DNA复制出m-RNA,借助于t-RNA所提供的氨基酸,合成出基因相关的蛋白质。所以从原始生命的“化学汤”看,不存在“先有鸡,后生蛋,或先有蛋,后生鸡”的争议了。从这个意义上,我们很容易理解到下列产生生命的基本模式,其中生命动力源自始至终起催化、激活动力作用:
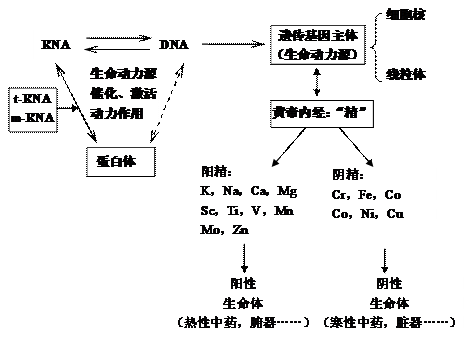
现在许多分子生物学中,常把RNA,DNA及蛋白体三者关系,称之为“中心法则”,但是遗憾的是很少提到生命动力源的催化、激活动力作用,其实这是最重要的生命动力因素,故在实际细胞核里DNA周围有很多很多种上述生命动力源含水络合离子,而且在不同的细胞核里,甚至在不同的细胞微器里生命动力源的分布不同,决定着基因的不同功能。
三、关于中国古代太极六十四卦图与基因t-RNA密码子
对氨基酸选择性的当代科学内涵
3.1 t-RNA反密码子和氨基酸与64卦对应关系
近年来随着宇航科技的发展,人们都很想发现地球外生命的存在,有些学者认为在无限大的宇宙里应该还有生命之物,甚至还有外星人类,但是有的学者认为在整个宇宙,地球上的人类,恐怕还是唯一的。笔者相当程度上赞成后一种看法,这是因为生命的出现,特别是人类的出现,其生命的化学演化过程具有非常特殊的规律:就是要遵循中国古代太极八卦及其扩张的六十四卦的规律。笔者难以想像外星的化学演化过程与环境是否能由这样的规律来支配?除非外星的化学环境满足下列的情况:现在让我们来看看生命的最重要的核心特质:DNA和蛋白质是如何配合的,就可以想像到在外星里做到这一点是多么难的事情!
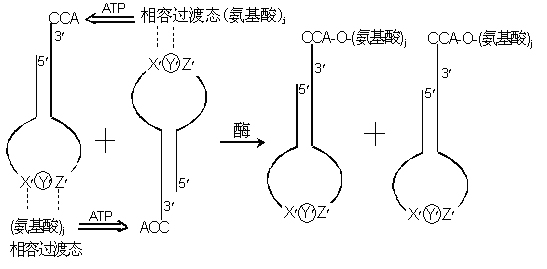
下面进一步探讨如何从DNA→RNA→蛋白体的过程:应该首先指出在上述过程中,为了使RNA合成蛋白体,首先由各种不同结构的t-RNA,通过其三联体反密码子,先识别不同氨基酸,形成中间过渡体结构,接着使不同氨基酸连到不同结构的t-RNA的3¢末端-CCA上,然后再按着m-RNA的要求,在核糖体内按着最佳基因序列链接到蛋白分子链上,可见m-RNA和t-RNA反密码之间有下列对应关系:
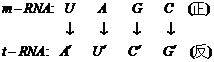
例如在m-RNA的正密码子:![]() ;
;
![]() ;……
;……
![]()
![]()
![]()
![]()
t-RNA的反密码子:![]() ;
;![]() ;……
;……![]()
这样可得下列有关反密码子和氨基酸对应关系的Watson’Table(见表2)。
表2 由t-RNA氨基酸与反密码子中心碱基之间形成的Watson’Table
|
t-RNA 反密码子 |
相容氨基酸 |
t-RNA 反密码子 |
相容氨基酸 |
t-RNA 反密码子 |
相容氨基酸 |
t-RNA 反密码子 |
相容氨基酸 |
||
|
3¢→5¢ |
3¢→5¢ |
3¢→5¢ |
3¢→5¢ |
||||||
|
A’ eq \o\ac(○,A')A'A’ A’ eq \o\ac(○,A')A'G’ |
Phe,F |
A’ eq \o\ac(○,G')G'A’ A’ eq \o\ac(○,G')G'G’ A’ eq \o\ac(○,G')G'U’ A’ eq \o\ac(○,G')G'C’ |
Ser,S |
A’ eq \o\ac(○,U')U'A’ A’ eq \o\ac(○,U')U'G’ |
Tyr,Y |
A’ eq \o\ac(○,C')C'A’ A’ eq \o\ac(○,C')C'G’ |
Cys,C |
||
|
A’ eq \o\ac(○,A')A'U’ A’ eq \o\ac(○,A')A'C’ |
Leu,L |
A’ eq \o\ac(○,U')U'U’ A’ eq \o\ac(○,U')U'C’ |
,Y 终止 |
A’ eq \o\ac(○,C')C'U’ A’ eq \o\ac(○,C')C'C’ |
,W 终止 |
||||
|
G’ eq \o\ac(○,A')A'A’ G’ eq \o\ac(○,A')A'G’ G’ eq \o\ac(○,A')A'U’ G’ eq \o\ac(○,A')A'C’ |
Leu,L |
G’ eq \o\ac(○,G')G'A’ G’ eq \o\ac(○,G')G'G’ G’ eq \o\ac(○,G')G'U’ G’ eq \o\ac(○,G')G'C’ |
Pro,P |
G’ eq \o\ac(○,U')U'A’ G’ eq \o\ac(○,U')U'G’ |
His,H |
G’ eq \o\ac(○,C')C'A’ G’ eq \o\ac(○,C')C'G’ G’ eq \o\ac(○,C')C'U’ G’ eq \o\ac(○,C')C'C’ |
Arg,R |
||
|
G’ eq \o\ac(○,U')U'U’ G’ eq \o\ac(○,U')U'G’ |
Gln,Q |
||||||||
|
U’ eq \o\ac(○,A')A'A’ U’ eq \o\ac(○,A')A'G’ U’ eq \o\ac(○,A')A'U’ |
Ile,I |
U’ eq \o\ac(○,G')G'A’ U’ eq \o\ac(○,G')G'G’ U’ eq \o\ac(○,G')G'U’ U’ eq \o\ac(○,G')G'C’ |
Thr,T |
U’ eq \o\ac(○,U')U'A’ U’ eq \o\ac(○,U')U'G’ |
Asn,N |
U’ eq \o\ac(○,C')C'A’ U’ eq \o\ac(○,C')C'G’ |
Ser,S |
||
|
U’ eq \o\ac(○,A')A'C’ |
,M 起始 |
U’ eq \o\ac(○,U')U'U’ U’ eq \o\ac(○,U')U'C’ |
Lys,K |
U’ eq \o\ac(○,C')C'U’ U’ eq \o\ac(○,C')C'C’ |
Arg,S |
||||
|
C’ eq \o\ac(○,A')A'A’ C’ eq \o\ac(○,A')A'G’ C’ eq \o\ac(○,A')A'U’ C’ eq \o\ac(○,A')A'C’ |
Val,V |
C’ eq \o\ac(○,G')G'A’ C’ eq \o\ac(○,G')G'G’ C’ eq \o\ac(○,G')G'U’ C’ eq \o\ac(○,G')G'C’ |
Ala,A |
C’ eq \o\ac(○,U')U'A’ C’ eq \o\ac(○,U')U'G’ |
Asp,D |
C’ eq \o\ac(○,C')C'A’ C’ eq \o\ac(○,C')C'G’ A’ eq \o\ac(○,C')C'U’ C’ eq \o\ac(○,C')C'C’ |
Gly,G |
||
|
C’ eq \o\ac(○,U')U'U’ C’ eq \o\ac(○,U')U'C’ |
Glu,E |
||||||||
|
|
|
|
|
|
|
|
|
||
由表2可以看出,共有64个密码子,而每一个密码子都有中心密码子 eq \o\ac(○,Y)Y;当中心碱基 eq \o\ac(○,A')A'时只与六种氨基酸匹配; eq \o\ac(○,G')G'只与五种氨基酸匹配;C¢则只与五种氨基酸匹配;而U¢只与七种氨基酸匹配。为什么会有这种匹配关系呢?这是连当代量子生物化学也无法回答的问题。
按照中国易经的看法,这是一个对立统一体的最典型的实例,且按一生二,二生三,形成三维立体空间的原理,最多可以形成64个三联体密码子:
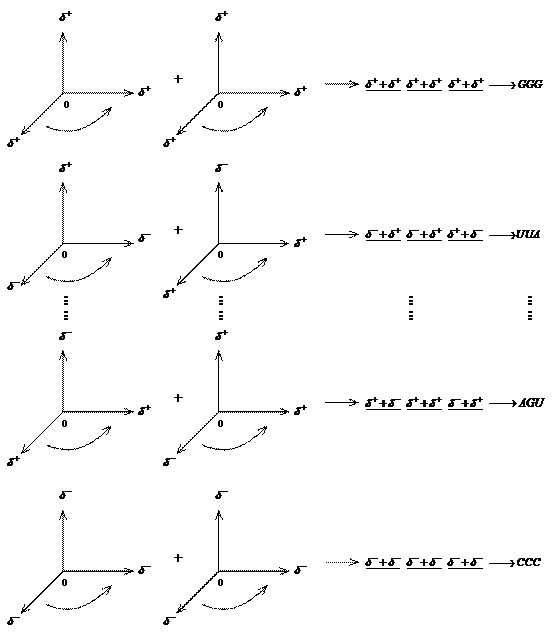
由此可得下列结果:
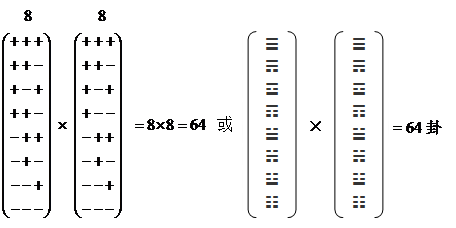
共有64种三联体密码子。
在这种情况下,由中国古代六十四卦图形可得随碱基阴阳不同而不同的氨基酸的分布图(见图1)。
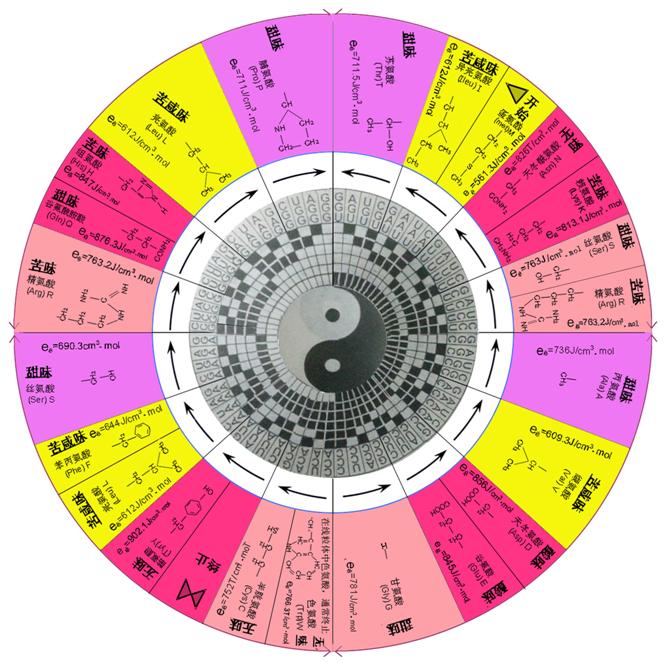
* 在图中所有密码子均为反密码子(即x¢y¢z¢)
图1 中国64卦对t-RNA反密码子和氨基酸关系的全息图
由上可以看出,中国古代八卦图非常有规律地描述了二十种氨基酸随t-RNA反密码子变化的全息关系,表现在下列几方面:
(1)由图1可以看出,20种氨基酸分成四大区,以靠近太极的密码子第一碱基为准,其分成四大区:每大区有红→紫→黄→兰。

其中G区有5种氨基酸(P、L、H、Q、 eq \o\ac(○,R)R)
A区有6种氨基酸( eq \o\ac(○,S)S、F、L、Y、C、W)
C区有5种氨基酸(G、E、D、V、A)
U区有7种氨基酸( eq \o\ac(○,R)R、 eq \o\ac(○,S)S、K、N、M、I)
其中精氨酸(R)和丝氨酸(S)出现两次,共二十种氨基酸。由此可知t-RNA反密码子(X¢ eq \o\ac(○,Y)Y¢Z¢)的第一碱基X¢是接纳不同阴阳性氨基酸的是重要门槛。
(2)从图1中可以看到,非常奇特的现象,那就是每大区里都由相同的密码子(X¢ eq \o\ac(○,Y)Y¢Z¢)中心碱基 eq \o\ac(○,Y)Y¢之颜色均为相同:
如: eq \o\ac(○,G)G¢ eq \o\ac(○,A)A¢ eq \o\ac(○,C)C¢ eq \o\ac(○,U)U¢
(兰色) (黄色) (红色) (紫色)
由此可以看出,t-RNA反密码子(X¢ eq \o\ac(○,Y)Y¢Z¢)的中心碱基 eq \o\ac(○,Y)Y¢分别对一类氨基酸,有相当高度的选择性。这说明中国古代八卦的预测与当代分子生物化学的结论是完全一致的。
(3)由图1还可以看出,t-RNA反密码子的第三碱基的顺序,以图形中线为基准,左侧是以![]() ,具有向左方式;而右侧是以
,具有向左方式;而右侧是以![]() ,具有向右方式。
,具有向右方式。
至于为什么t-RNA反密码子中心碱基( eq \o\ac(○,Y)Y¢)对氨基酸有那么突出的选择性问题,其内在原因,至今在前人的文献中并不清楚。因此本文的主要目的就是首次用内聚能密度的定量的方法来揭明其中的科学内涵。
3.2 首次发现t-RNA反密码子中心碱基 eq \o\ac(○,Y)Y的内聚能密度决定氨基酸的选择性
自从反密码子与氨基酸之间的Watson表出现以来人们一直在思考,为什么会有这种选择性?提出了各种观点,主要表现在两点:一是认为t-RNA环状结构的某些区段可能对不同氨基酸具有选择性,即由“副密码子”起作用,但是实际上搞不清楚哪一区域;二是认为有一种神秘的化学动力酶给t-RNA提供氨基酸的选择性。但是究竟是什么呢?至今没有能提供实体。在这种苦难之际,本文作者首次成功地发现了t-RNA的反密码子本身的四种中心碱基 eq \o\ac(○,Y)Y和四类氨基酸内聚能密度化学信息量之间有密切的关系,而氨基酸的共聚能力取决于反密码子中心碱基和氨基酸内聚能密度化学信息量大小的排序上。
3.2.1 量子化学从头计算之失败与内聚能密度化学结构信息量的新奇性
上世纪70年代,Van Krevlen等人提出了内聚能密度概念及其计算方法[9,10],作者首先用来判断不同分子间相容性以及共聚反应中竞聚率和单体内聚能密度之间的定量关系[5-8]。作者从中看到,内聚能密度的概念隐含着极大的生命力,要比量子化学从头计算方法优越许多倍,这是因为这一方法避开了分子间作用力与距离 r5~6 成反比的难题[4]。
遵循Einstein的名言“要从另一个角度来看问题”的教导,作者发现眼前内聚能密度概念非常成功地解释了氨基酸和密码子中心四种碱基之间的匹配关系。根据内聚能密度的定量数据,可按能量相近原则将氨基酸分成四大类,并与碱基的内聚能密度进行了比较,发现它们之间的匹配关系与Watson’s Table 具有令人满意的一致性。
众所周知,非共价键力包括生物体各分子间普遍存在的色散、极性(包括诱导极性)、氢键三大作用力,它是了解大分子的结构和相互作用的基础,而这些结构和相互作用是通过这三大作用的内聚能密度化学信息量来决定的。根据Van Krevlen提出的计算内聚能密度方式[9,10],可以分别得到色散力、极性力和氢键力相关的内聚能密度的计算公式(式1-3):
|
|
其中Fd、Fp、Fh分别为基团的色散、极性、氢键作用力参数;V为克分子体积,是由基团或原子贡献体积加和而得到。
根据上述计算公式,可分别计算遗传密码子中的各碱基的内聚能密度以及四类氨基酸的内聚能密度,然后我们可以进一步从分子结构的化学角度来全面地诠释碱基配对原则以及蛋白质合成过程中氨基酸与三联体反密码子第二碱基之间存在高选择性的问题。
3.2.2 从内聚能密度考察碱基与氨基酸之间定量关系,揭示人们所说的神秘的配对原则
根据上述计算公式,首先计算了五种碱基(A、T、G、C和U)的克分子体积及由各种作用力参数所贡献的内聚能密度以及各项内聚能密度之总和(![]() )和溶解参数
)和溶解参数![]() ,其结果列于表3中。
,其结果列于表3中。
表3 五种碱基内聚能密度e(J/cm3·mol)及克分子体积L(cm3/mol)
|
碱基 |
|
|
|
|
|
V |
|
T |
394 |
272 |
146 |
812 |
284 |
82.8 |
|
U |
348 |
335 |
167 |
850 |
29.2 |
72.3 |
|
A |
355(单环) 434(双环) |
69 |
139 |
563(单环) 642(双环) |
23.8 25.4 |
96.5 |
|
C |
365 |
204 |
198 |
767 |
27.7 |
77.9 |
|
G |
335(单环) 407(双环) |
127 |
185 |
647(单环) 719(双环) |
25.5 26.8 |
100 |
从表3可以看出所有碱基的内聚能密度都具有ed > ep > eh的特点。正如表3所指A、G分别都有单环和双环值,其中单环是与编码面有关,而双环与非编码面的内聚能密度有关,后者与脱氧核苷酸(核苷酸)单体在共聚反应前进入过渡态的抗聚合能力有关。考虑到与相容性的定量关系,可看出从eT与eU的溶解度参数δT=28.4、δU=29.2相差很小,且在m-RNA中都以U的形式出现,故不用T。现同样用Van Krevlen公式的方法,分别计算了所有氨基酸的内聚能密度,并列出了T(U)和A,G和C配对时,反密码子X’Y’Z’的中心碱基(Y’)的内聚能密度,见表4~表7。
表4 与m-RNA密码子第二碱基U和t-RNA反密码子A′相关的氨基酸的内聚能密度(J/cm3.mol)
|
t-RNA反密码子 中心碱基Y¢ |
HOOC—CH—NH2 R均为非级性的,疏水性基团; | 表中 eq \o\ac(○,X)X指DNA密码子中的第二碱基; R X’ 指t-RNA反密码子中的第二碱基; |
||||||
|
A′
|
相 关 密码子 |
C eq \o\ac(○,A)A′ |
G eq \o\ac(○,A)A′ |
U eq \o\ac(○,A)A′ |
A eq \o\ac(○,A)A′ |
U eq \o\ac(○,A)A′C |
|
|
氨基酸 |
缬氨酸 Val.V |
亮氨酸 Leu.L |
异亮氨酸 Ile.I |
苯丙氨酸 Phe.F |
甲硫氨酸 Met.M |
||
|
|
355 |
|
386.6 |
417 |
417 |
475 |
387 |
|
|
69 |
|
20.4 |
17.0 |
17.0 |
13.2 |
13.3 |
|
|
139 |
|
203 |
183 |
180 |
154 |
160 |
|
|
642 (25.4) |
|
609 (24.6) |
612.9 (24.8) |
612.9 (24.8) |
642.2 (25.4) |
561.3 (23.8) |
|
|
|
|
|
|
|
||
表中(
)指溶解度参数δ=![]() 值。
值。
由表4可以看出反密码子中心碱基A¢的总的内聚能密度(![]() )与五种氨基酸总的内聚能密度(
)与五种氨基酸总的内聚能密度(![]() )都非常相近,故这五种氨基酸与反密码子中心碱基
eq \o\ac(○,A)A¢相匹配,也就与正密码子T(U)间接有关。
)都非常相近,故这五种氨基酸与反密码子中心碱基
eq \o\ac(○,A)A¢相匹配,也就与正密码子T(U)间接有关。
表5 与m-RNA密码子第二碱基鸟嘌呤G和t-RNA反密码子C′相关的氨基酸内聚能密度(J/cm3.mol)
|
t-RNA反密码子 中心碱基Y¢ |
HOOC—CH—NH2 R 具有能够形成高氢键极性的氨基酸 | R |
||||||
|
eq \o\ac(○,C')C' |
相 关 密码子 |
A eq \o\ac(○,C)C′U (终止) |
G eq \o\ac(○,C)C′
U eq \o\ac(○,C)C′ |
C eq \o\ac(○,C)C′ |
U eq \o\ac(○,C)C′ |
A eq \o\ac(○,C)C′ |
|
|
氨基酸 |
色氨酸 Trp.W |
精氨酸 Arg.R |
甘氨酸 Gly.G |
丝氨酸 Ser.S |
半胱氨酸 Cys.C |
||
|
|
365 |
|
572 |
510 |
500 |
400 |
355 |
|
|
204 |
|
19.3 |
78.5 |
75 |
92.5 |
38.2 |
|
|
198 |
|
175 |
174* |
206* |
271* |
359 |
|
|
767 (27.7) |
|
766.3 (27.6) |
763.5 (27.5) |
781 (28.0) |
763.5 (27.5) |
752.2 (27.4) |
|
|
|
|
|
|
|
||
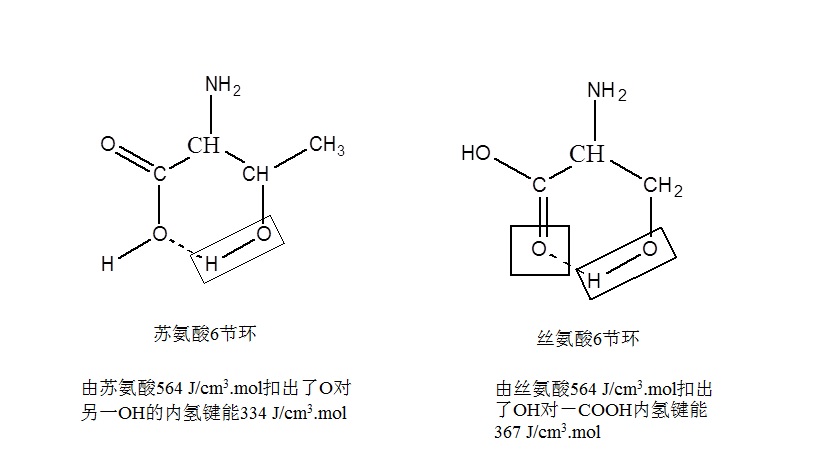
注 *指已扣出分子内氢键内聚能密度值。
红外光谱表明,表中甘氨酸、丝氨酸、精氨酸在疏水条件下,均能形成分子内氢键,故在计算内聚能密度时应扣出分子内氢键作用能,例如:
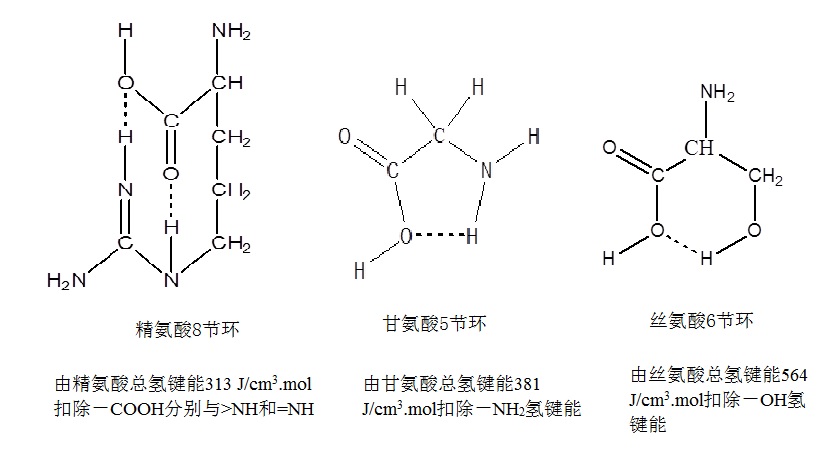 |
总之从表5中又一次可以看到反密码子中心碱基
eq \o\ac(○,C)C¢的![]() 与五种氨基酸的
与五种氨基酸的![]() 也相当接近,故这五种氨基酸与
eq \o\ac(○,C)C¢相匹配。
也相当接近,故这五种氨基酸与
eq \o\ac(○,C)C¢相匹配。